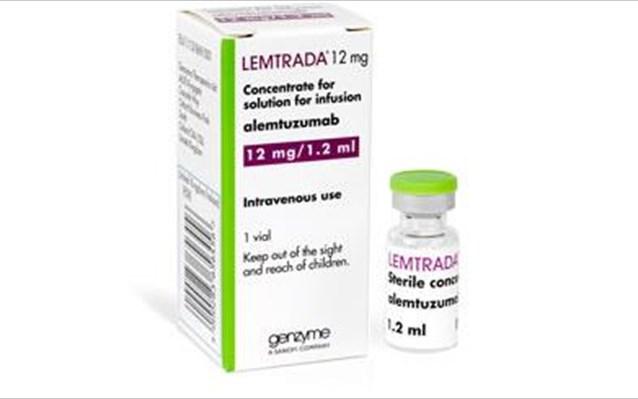
Τον περιορισμό της χρήσης του Lemtrada (alemtuzumab) σε ασθενείς με σκλήρυνση κατά πλάκας λόγω αναφορών για σπάνιες αλλά σοβαρές ανεπιθύμητες ενέργειες, συμπεριλαμβανομένων θανάτων συστήνει ο Ευρωπαϊκός Οργανισμός Φαρμάκων (European Medicine Agency – EMA). Επίσης συστήνονται νέα μέτρα για την αναγνώριση και τη διαχείριση των σοβαρών ανεπιθύμητων ενεργειών.
Οι ανεπιθύμητες ενέργειες περιλαμβάνουν καρδιαγγειακές διαταραχές (που επηρεάζουν την καρδία, την κυκλοφορία, την αιμορραγία καθώς και εγκεφαλικό επεισόδιο) και ανοσολογικές διαταραχές (που προκαλούνται από το αμυντικό σύστημα του σώματος που δεν λειτουργεί σωστά).
Το Lemtrada θα πρέπει τώρα να χρησιμοποιείται μόνο σε ασθενείς με υψηλής ενεργότητας υποτροπιάζουσα – διαλείπουσα σκλήρυνση κατά πλάκας παρά τη θεραπεία με τουλάχιστον μια θεραπεία τροποποίησης της νόσου ή αν η πάθηση επιδεινώνεται ραγδαία.
Το Lemtrada δεν θα πρέπει πλέον να χρησιμοποιείται σε ασθενείς με συγκεκριμένες διαταραχές της καρδίας, της κυκλοφορίας ή αιμορραγίας ή σε ασθενείς με αυτοάνοσες παθήσεις άλλες από τη σκλήρυνση κατά πλάκας.
Σύμφωνα με τον ΕΜΑ, το φάρμακο θα πρέπει να χορηγείται σε νοσοκομείο με έτοιμη πρόσβαση σε μονάδες εντατικής θεραπείας και με ειδικούς που μπορούν να διαχειριστούν σοβαρές ανεπιθύμητες ενέργειες.
Ενώ, έχει συστήσει και την επικαιροποίηση του οδηγού ιατρών και το πακέτο πληροφοριών για τους ασθενείς με συμβουλές για την ελαχιστοποίηση των κινδύνων σοβαρών καρδιαγγειακών διαταραχών που μπορεί να προκύψουν σύντομα μετά την έγχυση του Lemtrada (στάγδην), κυκλοφοριακών και αιμορραγικών διαταραχών που μπορεί να εμφανιστούν αμέσως με και ανοσολογικές διαταραχές που μπορεί να προκύψουν πολλούς μήνες και πιθανόν πολλά χρόνια μετά την τελευταία θεραπεία.
Αυτές οι συστάσεις εκδόθηκαν από την επιτροπή αξιολόγησης κινδύνων φαρμακοεπαγρύπνησης (PRAC) του EMA και έχουν εγκριθεί από την Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) του EMA.
Θα αντικαταστήσουν τα προσωρινά μέτρα που εκδόθηκαν τον Απρίλιο του 2019, ενώ ήταν υπό εξέλιξη η ανασκόπηση του Lemtrada. Οι αλλαγές θα τεθούν σε ισχύ όταν εκδώσει την απόφαση της η Ευρωπαϊκή Επιτροπή.